Pendahuluan
Aldehida adalah salah satu kelompok senyawa organik yang memiliki peran penting dalam kimia dan industri. Dengan struktur kimia yang unik, aldehida terlibat dalam berbagai reaksi kimia dan digunakan dalam produksi banyak bahan kimia dan produk sehari-hari. Artikel ini akan membahas struktur dan sifat aldehida, reaksi kimia utama yang melibatkan aldehida, serta aplikasi dan pentingnya dalam industri dan kehidupan sehari-hari.
Kata aldehida berasal dari bahasa Latin dehydrogenatum yang berarti alkohol terdehidrogenasi. Dalam pengertian ini, aldehida adalah senyawa organik yang bercirikan memiliki gugus fungsi –CHO. Berbeda dengan gugus fungsi lain yang mengandung gugus karbonil C=O, aldehida hanya berikatan dengan radikal dan melalui ikatan yang berbeda, dengan hidrogen.
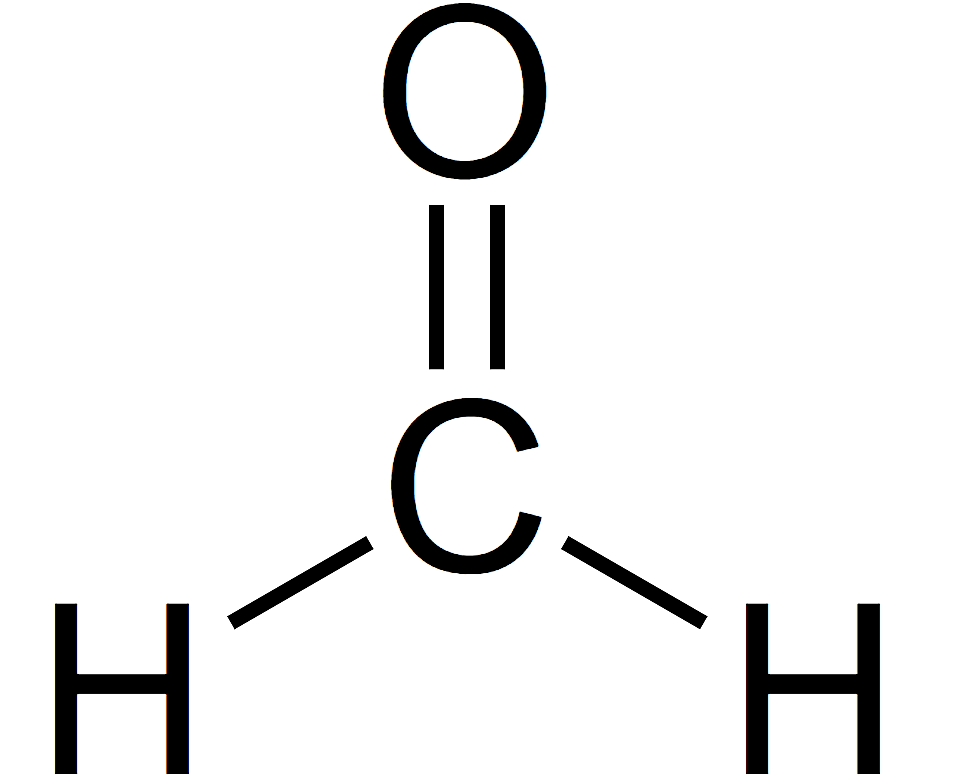
Apa itu aldehida?
Aldehida adalah senyawa organik yang memiliki gugus fungsi CHO dan memiliki gugus karbonil -CO sebagai fungsinya dan rumus RCHO dan diperoleh dari oksidasi alkohol primer.
Definisi
Aldehida adalah senyawa organik yang mengandung gugus karbonil (C=O) yang terikat pada atom hidrogen dan atom karbon lainnya. Gugus fungsi aldehida dapat dinyatakan sebagai −CHO. Struktur ini memberikan aldehida sifat kimia yang khas dan berbeda dari keton, yang juga mengandung gugus karbonil tetapi terikat pada dua atom karbon.
Ciri-ciri aldehida
Ciri-ciri utama aldehida adalah:
- Mereka memiliki kelompok fungsional CHO.
- Mereka disebut seperti alkohol yang sesuai dan dapat mengubah akhirannya.
- Mereka diperoleh dari oksidasi lembut alkohol primer.
- Reaksinya adalah adisi nukleofilik.
- Dengan adanya karbonil mereka menjadi senyawa polar.
- Mereka larut dalam air dan tidak larut dalam pelarut organik.
Sifat Fisik
Aldehida umumnya memiliki titik didih lebih rendah dibandingkan alkohol dengan berat molekul yang sama, karena mereka tidak dapat membentuk ikatan hidrogen intermolekuler seperti alkohol. Aldehida dengan rantai karbon pendek biasanya memiliki bau yang tajam dan menyengat, sementara yang lebih panjang cenderung memiliki bau yang lebih lembut.
Polarisasi Gugus Karbonil
Gugus karbonil pada aldehida bersifat polar, dengan oksigen yang lebih elektronegatif menarik elektron dari karbon, sehingga memberikan muatan parsial negatif pada oksigen dan positif pada karbon. Polarisasi ini membuat aldehida reaktif terhadap nukleofil, yang akan menyerang karbon yang kekurangan elektron.
Klasifikasi
Mereka diklasifikasikan berdasarkan keluarga, dengan cara ini kita memiliki:
- Keluarga pertama (Cn H2n O): metil atau format, etil atau asetat, propil, butil, valerat, enantilik.
- Keluarga ke-2 (Cn H2n-2 O): alelik atau akrolein, proton, isocapric.
- Keluarga ke-3 (Cn H2n-4 O): tidak ada aldehida dari golongan ini yang diketahui.
- Keluarga ke-4 (Cn H2n-6 O): tidak ada aldehida dari keluarga ini yang diketahui.
- Keluarga ke-5 (Cn H2n-8 O): benzilik, toluat, kumina.
- Keluarga ke-6 (Cn H2n-10 O): aldehida sinamat (sari kayu manis).
- Keluarga ke-7 (Cn H2n-14 O): aldehida isonaphthoic.
Struktur
Strukturnya berbentuk trigonal planar karena karbon utamanya mengalami hibridisasi dengan 3 orbital atom sp2 dan 1 orbital p. Orbital-orbital ini terikat dengan orbital atom karbon lainnya, yaitu 1sp2-s, dengan hidrogen, 1sp2-sp2, dan 1p-p, keduanya dengan oksigen, dan terakhir, 1sp2-sp3, dengan radikal. Jadi aldehida mempunyai ikatan 3 sigma dan ikatan pi dan dengan cara ini sudut yang dibentuk oleh ikatan karbon dengan ketiga atom yang terikat adalah kira-kira 120.
Rumus
Rumus umum aldehida adalah: CnH2n+1CHO
dimana n = 0, 1, 2, 3, 4,… sesuai dengan jumlah atom Karbon dalam hidrokarbon.
Tata nama
Sehubungan dengan tata nama, akhiran “-al” ditambahkan ke hidrokarbon yang setara. Jika ada dua gugus aldehida, ditambahkan akhiran “-dial”. Untuk tiga kelompok atau lebih, awalan «formil-« digunakan. Ada juga tata nama tradisional untuk aldehida yang paling umum:
- Metanal HCHO → Formaldehida
- CH3-CH2-CH2-CHO Butanal → Butyraldehyde atau Butyl Aldehyde
Sifat fisik aldehida
Yang memiliki sedikit karbon memiliki bau yang khas. Misalnya, metanal menghasilkan air mata dan berbentuk gas. Kebanyakan dari mereka adalah cairan dan sisanya adalah padatan. Titik didihnya lebih rendah dibandingkan dengan masing-masing alkohol yang memiliki jumlah karbon yang sama. Mereka mempunyai kepadatan yang lebih rendah daripada air dan yang terkecil memiliki kelarutan tertentu dalam air, namun kepadatan ini menurun seiring dengan meningkatnya jumlah karbon.
Asetaldehida memiliki berat molekul 44 dan titik didih 21°C, sedangkan etanol dengan berat 46 mendidih pada 78°C.
Sifat kimia
Mereka memiliki reaktivitas yang baik. Mereka menyajikan reaksi penambahan, substitusi dan kondensasi.
Adisi: terjadi ketika hidrogen ditambahkan dan alkohol primer terbentuk.
Substitusi dengan halogen: terjadi pada aldehida ketika bereaksi dengan klor menghasilkan asam klorida melalui substitusi hidrogen pada gugus karbonil.
Mereka juga berperilaku sebagai zat pereduksi melalui oksidasi asam yang memiliki jumlah atom karbon yang sama. Reaksi aldehida dan keton dikenal sebagai adisi nukleofilik.
Pentingnya
Mereka mempunyai pengaruh yang besar terhadap perekonomian dunia karena berkat mereka industri wewangian, misalnya, menjadi begitu penting. Alkohol sangat penting dalam pembuatan produk di industri. Reaksinya harus serba guna dan harganya terjangkau. Aldehida adalah penghasil utama alkohol sederhana.
Memperoleh
Mereka pada dasarnya dapat dibuat dengan oksidasi lembut alkohol primer. Mereka juga dapat diperoleh melalui proses berikut:
- Oksidasi alkohol: oksidasi langsung alkohol primer menjadi asam karboksilat umumnya terjadi melalui aldehida yang sesuai, yang kemudian diubah melalui reaksi dengan air menjadi aldehida hidrat.
- Hidrasi alkuna: alkuna dua karbon terhidrasi dan dengan cara ini dapat membentuk aldehida yang sesuai; Alkuna lainnya selalu terhidrasi dan membentuk keton. Reaksi ini berlangsung melalui mekanisme yang dikenal sebagai tautomerisasi.
- Reduksi Asil Halida: Asil halida direduksi dengan hidrogen ketika ada paladium dan varium sulfat dan menghasilkan aldehida.
- Reduksi atau hidrogenasi katalitik: aldehida dan keton dapat mengalami adisi langsung dengan hidrogen, membentuk alkohol primer dan sekunder
Reaksi
Reaksi yang terjadi pada aldehida adalah sebagai berikut:
- Oksidasi: ketika bereaksi dengan oksidan kuat dalam media asam, asam karboksilat terbentuk.
- Reduksi: bila dikombinasikan dengan litium aluminium hidrida, alkohol primer dihasilkan.
- Hidrasi: dalam media berair, hidrat dapat diubah menjadi aldehida lagi
- Asetilasi: dalam media alkohol, terjadi asetilasi karbonil, yang dapat berupa hemiasetal atau diasetal, dan aldehida dapat diperoleh dengan hidrolisis asam.
- Reaksi dengan pereaksi Grignard: adisi nukleofilik kemudian terjadi, menghasilkan alkohol sekunder.
- Reaksi Wittig: Reaksi ini menghasilkan alkena.
- Kondensasi aldol: terjadi hidrolisis senyawa, membentuk aldehida tak jenuh.
- Penambahan sianida: sianohidrin diproduksi.
- Reaksi Betty: Ini adalah reaksi organik antara aldehida, amina aromatik dan fenol menghasilkan α-aminobenzilfenol.
- Pembentukan semikarbazon: dalam medium asam dapat menghasilkan semikarbazon.
Reaksi Oksidasi
Aldehida dapat dioksidasi menjadi asam karboksilat. Reaksi ini sering digunakan dalam analisis kimia untuk mengidentifikasi aldehida. Pereaksi seperti larutan Tollens atau larutan Fehling dapat digunakan untuk menguji keberadaan aldehida melalui reaksi oksidasi ini.
Reaksi Reduksi
Aldehida dapat direduksi menjadi alkohol primer menggunakan agen pereduksi seperti natrium borohidrida (NaBH4) atau litium aluminium hidrida (LiAlH4). Reaksi ini penting dalam sintesis kimia untuk mengubah aldehida kembali menjadi alkohol.
Reaksi Adisi Nukleofilik
Aldehida dapat bereaksi dengan nukleofil seperti amina atau alkohol melalui reaksi adisi nukleofilik, membentuk senyawa seperti imina atau hemi-asetal. Reaksi ini adalah dasar untuk banyak reaksi sintesis dalam kimia organik.
Kegunaan aldehida
Aldehida dapat memiliki kegunaan berikut:
- Dalam pembuatan produk plastik, resin dan akrilik.
- Mereka digunakan dalam industri fotografi; mudah meledak dan mewarnai.
- Mereka bekerja sangat baik sebagai antiseptik dan pengawet.
- Sebagai herbisida, fungisida dan pestisida.
- Dalam percepatan vulkanisasi.
- Di industri makanan dan parfum.
- Industri tekstil dan farmasi.
- Produksi pakan.
- Dalam larutan berair 40% disebut formaldehida dan digunakan dalam industri untuk mengawetkan kayu, kulit, dan taksidermi.
- Etanal digunakan dalam pembuatan cermin (reaksi Tollens dan dalam pembuatan asam asetat.
Contoh
Beberapa contoh aldehida adalah sebagai berikut:
- Formaldehida atau Formol
- Asetaldehida atau Etanal
- Propionaldehida atau Propanal
- Butyraldehyde atau Butanal
- Pentanal
- heksanal
- Benzaldehida
- Tolualdehida
- Salisilatdehida
- Fenil Asetaldehida
Aplikasi Aldehida
Produksi Bahan Kimia
Aldehida seperti formaldehida dan asetaldehida adalah bahan antara penting dalam produksi berbagai bahan kimia, termasuk plastik, resin, dan pelarut. Formaldehida, misalnya, digunakan dalam produksi resin fenolik dan urea-formaldehida yang digunakan dalam industri kayu dan tekstil.
Industri Parfum dan Aroma
Banyak aldehida memiliki aroma yang khas dan digunakan dalam industri parfum untuk memberikan aroma segar atau floral. Contohnya, citral dan benzaldehida digunakan sebagai bahan penyedap dan pengharum dalam produk makanan dan kosmetik.
Aplikasi Medis dan Farmasi
Aldehida juga digunakan dalam industri farmasi untuk sintesis obat-obatan dan sebagai agen pengawet. Formaldehida, misalnya, digunakan dalam pengawetan spesimen biologis dan sebagai desinfektan.
Tantangan dan Keamanan
Toksisitas dan Bahaya
Beberapa aldehida, terutama formaldehida, bersifat toksik dan dapat menyebabkan iritasi kulit, mata, dan saluran pernapasan. Paparan jangka panjang terhadap formaldehida dikaitkan dengan risiko kesehatan yang serius, termasuk kanker. Oleh karena itu, penanganan yang hati-hati dan penggunaan alat pelindung diri diperlukan saat bekerja dengan aldehida.
Pengelolaan Limbah
Pengolahan limbah yang mengandung aldehida memerlukan perhatian khusus untuk mencegah dampak lingkungan. Proses pengolahan harus memastikan aldehida terurai atau dinetralisasi sebelum dilepaskan ke lingkungan.
Kesimpulan
Aldehida adalah kelompok senyawa organik yang penting dengan berbagai aplikasi dalam industri kimia, parfum, dan farmasi. Dengan memahami struktur dan reaksi kimia aldehida, kita dapat memanfaatkan sifat unik mereka untuk berbagai aplikasi praktis. Meskipun menghadapi tantangan terkait toksisitas dan pengelolaan limbah, inovasi dalam teknologi dan praktik pengelolaan yang baik dapat mengurangi risiko dan memaksimalkan manfaat dari senyawa ini.
Referensi
- Morrison, R. T., & Boyd, R. N. (2010). Organic Chemistry. Pearson Education.
- Solomons, T. W. G., & Fryhle, C. B. (2011). Organic Chemistry. John Wiley & Sons.
- Bruice, P. Y. (2016). Organic Chemistry. Pearson Education.
- McMurry, J. (2015). Organic Chemistry. Cengage Learning.
- Kementerian Pendidikan dan Kebudayaan Republik Indonesia. (2021). Buku Kimia untuk SMA Kelas XII.