Pendahuluan
Elektrolisis adalah proses kimia yang menggunakan arus listrik untuk memicu reaksi kimia non-spontan. Proses ini memiliki banyak aplikasi penting dalam industri dan laboratorium, termasuk pemurnian logam, produksi gas, dan pembuatan senyawa kimia. Artikel ini akan membahas prinsip dasar elektrolisis, bagaimana proses ini berlangsung, serta berbagai aplikasi dan pentingnya dalam kehidupan sehari-hari dan industri.
Elektrolisis adalah suatu proses dimana unsur-unsur dalam suatu senyawa dapat dipisahkan dengan menggunakan listrik. Beberapa zat seperti garam dan beberapa oksida logam merupakan penghantar listrik yang baik dan mengalami penguraian ketika mengalami aliran arus listrik. Zat-zat ini disebut elektrolit, dan fenomena ini disebut elektrolisis. Ini adalah proses oksidasi dan reduksi yang melibatkan peningkatan energi bebas sistem yang membutuhkan gaya energi eksternal. Reaksi yang terjadi pada proses elektrolisis ditentukan oleh hukum energi.
Apa itu elektrolisis?
Elektrolisis adalah proses dimana arus listrik melewati suatu zat untuk mempengaruhi perubahan kimia di dalamnya, menghasilkan pemisahan. Perubahan kimia adalah suatu zat yang kehilangan atau memperoleh elektron dan dapat berupa oksidasi atau reduksi.
Definisi dan Konsep Dasar
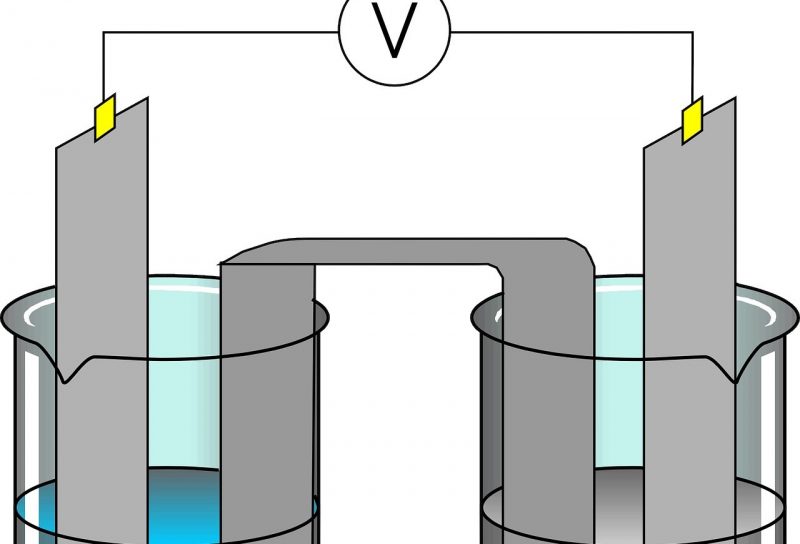
Elektrolisis adalah proses menggunakan arus listrik untuk memecah senyawa kimia menjadi komponennya. Proses ini dilakukan dalam sel elektrolitik, yang terdiri dari dua elektroda yang dicelupkan ke dalam larutan elektrolit. Ketika arus listrik dialirkan melalui larutan, ion-ion dalam larutan bergerak menuju elektroda dengan muatan berlawanan, menghasilkan reaksi kimia pada permukaan elektroda.
Sel Elektrolitik
Sel elektrolitik adalah perangkat yang digunakan untuk melaksanakan elektrolisis. Sel ini terdiri dari dua elektroda: anoda (elektroda positif) dan katoda (elektroda negatif). Larutan elektrolit di dalam sel mengandung ion-ion yang bergerak menuju elektroda masing-masing sesuai dengan muatannya.
Sejarah elektrolisis
Adalah William Whewell dari Inggris, seorang ilmuwan besar, filsuf dan penulis banyak teks, yang bersama dengan Michael Faraday pada tahun 1834 menemukan istilah “elektrolisis” untuk mendefinisikan proses dekomposisi kimiawi arus galvanik. Pada awal abad ke-19, kata ini dengan cepat diperkenalkan ke bidang kimia, mineralogi, dan metalurgi melalui serangkaian percobaan di mana, dengan memasukkan listrik ke dalam suatu zat, berbagai jenis penguraian dapat timbul, sehingga memungkinkan kita untuk mengetahui dan memahami. unsur-unsur zat tersebut. Pada tahun 1850-an dan 1860-an, eksperimen medis dilakukan di Amerika Utara dan Eropa dengan menggunakan elektrolisis.
Untuk apa ini?
Metalurgi elektro: Banyak logam yang sangat reaktif, seperti logam yang termasuk dalam golongan 1 dan 2, diekstraksi dari matriksnya melalui elektrolisis mineral cairnya. Logam seperti natrium dan magnesium diproduksi melalui elektrolisis lelehan kloridanya. Aluminium murni diperoleh dari larutan oksidanya dalam kriolit cair. Aluminium ini digunakan dalam pembuatan beberapa zat penting seperti hidrogen, klorin, natrium hidroksida, dan oksigen. Ini digunakan dalam produksi aluminium, litium, natrium, asam klorida, kalium klorida, kalium hidrogen, dan magnesium. Ini digunakan dalam larutan garam untuk menghasilkan klorin yang digunakan dalam air kolam renang. Melalui elektrolisis anodisasi, logam dalam keadaan korosi dapat dilindungi.
Proses Elektrolisis
Kita dapat memahami prosesnya dengan melihat contoh yang melibatkan pemurnian logam tembaga. Proses ini memerlukan anoda, elektroda bermuatan positif, dan katoda, elektroda bermuatan negatif. Dalam hal ini, logam tembaga yang tidak murni adalah anoda, sedangkan logam tembaga murni adalah katoda.
Reaksi di Anoda dan Katoda
- Anoda: Di anoda, oksidasi terjadi. Ion negatif (anion) melepaskan elektron dan berubah menjadi zat netral atau gas. Misalnya, dalam elektrolisis air, ion hidroksida (OH−) kehilangan elektron membentuk oksigen gas (O2) dan air.
- Katoda: Di katoda, reduksi terjadi. Ion positif (kation) menerima elektron dan berubah menjadi zat netral atau logam. Misalnya, dalam elektrolisis air, ion hidrogen (H+) menerima elektron membentuk hidrogen gas (H2).
Persamaan Reaksi
Dalam proses elektrolisis, reaksi kimia dapat dinyatakan dengan persamaan reaksi redoks yang menggambarkan transfer elektron antara anoda dan katoda. Sebagai contoh, elektrolisis air dapat dinyatakan sebagai:
2H2O(l)→2H2(g)+O2(g)
Bagaimana cara kerjanya
Konduktivitas listrik suatu zat adalah perpindahan muatan listrik yang melaluinya. Perpindahan muatan ini dapat terjadi melalui dua cara: melalui aliran elektron, seperti yang biasa terjadi pada logam, dan yang disebut konduktor jenis pertama; dan melalui pergerakan ion positif dan negatif, melalui larutan atau senyawa ionik fluida. Bentuk konduktifitas ini dikenal sebagai konduktifitas ionik, disebut juga konduktifitas elektrolitik, yaitu konduktifitas elektrolit yang merupakan konduktor jenis kedua. Ini kemudian merupakan proses di mana aliran arus listrik melalui larutan atau cairan elektrolit menghasilkan reaksi oksidasi – reduksi, yang lebih dikenal sebagai redoks.
Aplikasi
Melalui proses elektrolisis, berbagai senyawa dapat diuraikan menjadi unsur-unsurnya, seperti hidrogen. Ini juga digunakan untuk memurnikan logam seperti tembaga. Ini juga digunakan untuk menutupi beberapa logam dengan logam lain untuk mempercantik atau mencegah korosi. Logam yang biasa diendapkan adalah emas, perak, kromium, timah dan proses ini disebut pelapisan listrik.
Pemurnian Logam
Elektrolisis digunakan dalam pemurnian logam seperti tembaga dan aluminium. Dalam proses ini, logam yang tidak murni bertindak sebagai anoda, dan logam murni mengendap di katoda. Proses ini meningkatkan kemurnian logam yang dihasilkan.
Produksi Gas
Elektrolisis adalah metode penting untuk memproduksi gas seperti hidrogen dan oksigen. Hidrogen yang dihasilkan melalui elektrolisis air digunakan sebagai bahan bakar alternatif dan dalam industri kimia. Oksigen digunakan dalam aplikasi medis dan industri.
Pembuatan Senyawa Kimia
Elektrolisis digunakan untuk memproduksi senyawa kimia seperti natrium hidroksida (NaOH) dan klorin (Cl2) dari larutan garam dapur. Proses ini dikenal sebagai elektrolisis brine dan memiliki banyak aplikasi dalam industri kimia.
Pelapisan Elektro (Electroplating)
Dalam industri perhiasan dan otomotif, elektrolisis digunakan untuk melapisi permukaan logam dengan lapisan tipis logam lain, seperti emas atau kromium. Proses ini meningkatkan penampilan dan ketahanan korosi dari produk.
Elektrolisis air
Agar dapat berfungsi, elektrolisis air mengharuskan air tidak dalam keadaan murni, melainkan harus memiliki konsentrasi garam dan beberapa mineral tertentu; dan arus searah harus digunakan selama proses. Hal ini memungkinkan kita memperoleh unsur kimia, seperti hidrogen dan oksigen. Dapat diterapkan pada air tawar atau air asin, memperoleh hasil yang berbeda. Dari air garam kita akan memperoleh klorin dan hidrogen dalam bentuk gas.
Elektrolisis natrium klorida
Ion klorida kehilangan elektronnya ketika berubah menjadi atom klor, yang kemudian membentuk molekul gas klor. Reaksi anodik yang terjadi dalam hal ini adalah oksidasi. Reaksi elektroda ini disebut setengah reaksi, dan reaksi keseluruhan elektrolisis natrium klorida adalah: 2Na+ + 2Cl- → 2Na ° + Cl2.
Tantangan dan Inovasi dalam Elektrolisis
Efisiensi Energi
Salah satu tantangan utama dalam elektrolisis adalah konsumsi energi yang tinggi. Penelitian sedang dilakukan untuk mengembangkan metode yang lebih efisien secara energi, termasuk penggunaan katalis yang lebih efektif dan sumber energi terbarukan.
Dampak Lingkungan
Proses elektrolisis dapat menghasilkan produk sampingan yang berpotensi berbahaya bagi lingkungan. Inovasi dalam pengolahan limbah dan teknologi hijau diperlukan untuk meminimalkan dampak lingkungan dari aplikasi elektrolisis.
Material Elektroda
Pengembangan material elektroda yang lebih tahan lama dan efisien adalah area penelitian yang aktif. Material baru dapat meningkatkan efisiensi dan umur panjang sel elektrolitik.
Kesimpulan
Elektrolisis adalah proses kimia penting yang memiliki berbagai aplikasi dalam industri dan laboratorium. Dengan memanfaatkan arus listrik untuk memicu reaksi kimia, elektrolisis memungkinkan produksi logam murni, gas, dan senyawa kimia yang digunakan dalam kehidupan sehari-hari dan industri. Meskipun menghadapi tantangan dalam efisiensi energi dan dampak lingkungan, inovasi dalam teknologi elektrolisis terus berkembang untuk menjawab tantangan ini.
Referensi
- Atkins, P., & de Paula, J. (2014). Physical Chemistry. Oxford University Press.
- Brown, T. L., LeMay, H. E., Bursten, B. E., & Murphy, C. J. (2012). Chemistry: The Central Science. Pearson Education.
- Silberberg, M. S. (2012). Chemistry: The Molecular Nature of Matter and Change. McGraw-Hill Education.
- Petrucci, R. H., Harwood, W. S., Herring, F. G., & Madura, J. D. (2011). General Chemistry: Principles and Modern Applications. Prentice Hall.
- Kementerian Pendidikan dan Kebudayaan Republik Indonesia. (2021). Buku Kimia untuk SMA Kelas XII.