Pendahuluan
Hukum Kekekalan Materi adalah salah satu prinsip fundamental dalam kimia dan fisika yang menyatakan bahwa materi tidak dapat diciptakan atau dimusnahkan dalam reaksi kimia. Prinsip ini memainkan peran penting dalam pengembangan ilmu pengetahuan modern dan menjadi dasar bagi banyak konsep ilmiah. Artikel ini akan membahas konsep dasar, sejarah perkembangan, serta aplikasi hukum kekekalan materi dalam berbagai bidang.
Apa hukum kekekalan materi?
Hukum kekekalan materi adalah hukum yang menyatakan bahwa, dalam sistem tertutup, jumlah materi yang terlibat dalam reaksi kimia adalah tetap.
Dengan sistem tertutup, kami memahami lingkungan yang mengisolasi komponen yang terlibat dalam reaksi dari luar, seperti wadah tertutup.
Ketika transformasi dilakukan melalui proses fisik, tidak ada perubahan yang diamati pada massa.
Dengan kata lain, jika kita mengisi wadah dengan air dan membekukannya, jumlah airnya tidak bertambah atau berkurang, hanya berubah wujudnya dari cair menjadi padat.
Proses tersebut tidak mengubah massa unsur-unsur yang ikut serta dalam reaksi, ia hanya menyebabkan organisasi baru dalam strukturnya. Kita akan memiliki jumlah materi yang sama di awal dan di akhir reaksi tersebut.
Pernyataan yang paling tepat menggambarkan apa yang didalilkan hukum ini adalah:
“Di alam tidak ada yang diciptakan atau dihancurkan, semuanya diubah” (A. Lavoisier, 1785)
Hukum kekekalan materi dikembangkan pada abad ke-18 berkat dua ilmuwan, Mikhail Lomonosov dan Antoine Lavoisier, yang secara paralel mencapai kesimpulan serupa.
Banyak fakta dari hari ke hari kita menunjukkan apa yang dipegang oleh prinsip dasar kimia ini.
Definisi dan Konsep Dasar
Hukum Kekekalan Materi, juga dikenal sebagai Hukum Kekekalan Massa, menyatakan bahwa massa total zat-zat dalam sistem tertutup tetap konstan selama reaksi kimia. Ini berarti bahwa jumlah materi sebelum dan sesudah reaksi kimia adalah sama, meskipun zat-zat tersebut dapat berubah bentuk atau bergabung menjadi zat baru.
Secara matematis, hukum ini dapat dinyatakan sebagai:
Massa reaktan=Massa produk
Reaksi Kimia dan Sistem Tertutup
Dalam konteks reaksi kimia, sistem tertutup adalah sistem di mana tidak ada pertukaran materi dengan lingkungan sekitarnya. Dalam sistem semacam ini, semua atom yang ada sebelum reaksi akan tetap ada setelah reaksi, meskipun mereka mungkin membentuk senyawa baru.
Sejarah Perkembangan Hukum Kekekalan Materi
Antoine Lavoisier
Hukum Kekekalan Materi pertama kali dirumuskan oleh Antoine Lavoisier, seorang ahli kimia Prancis, pada abad ke-18. Melalui serangkaian eksperimen yang teliti, Lavoisier menunjukkan bahwa massa zat sebelum dan sesudah reaksi kimia adalah sama. Karyanya menjadi dasar bagi kimia modern dan mengubah cara ilmuwan memahami reaksi kimia.
Pengaruh terhadap Ilmu Pengetahuan
Penemuan Lavoisier membuka jalan bagi perkembangan lebih lanjut dalam kimia, termasuk tabel periodik dan teori atom. Hukum Kekekalan Materi juga memainkan peran penting dalam pengembangan termodinamika dan fisika modern.
Contoh hukum kekekalan materi
Berikut adalah beberapa situasi yang mengkonfirmasi hukum ini:
Pembusukan buah
Pengurangan ukuran makanan saat terdegradasi sangat penting. Hal ini berubah menjadi gas yang dilepaskan ke lingkungan.
mencairkan es
Saat meninggalkan gelas dengan es pada suhu kamar, es akan mencair. Jumlah zat yang tertinggal dalam wadah adalah sama, hanya keadaannya saja yang diubah.
Air mendidih
Mendidih air juga menjadi contoh, karena ketika mendidih, air dikonsumsi dan diubah menjadi uap, yang tetap berada di lingkungan.
benda berkarat
Benda logam, biasanya besi, berkarat karena terpapar oksigen. Oksigen bereaksi dengan logam menghasilkan lapisan oksida pada permukaannya.

pembentukan senyawa
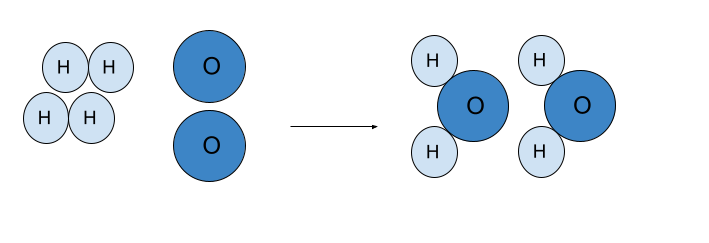
Dalam pembentukan air, dua molekul hidrogen (2 H 2 ) bereaksi dengan satu molekul oksigen (O 2 ) menghasilkan dua molekul air (2H 2 O). Seperti yang kita lihat pada gambar, jumlah atom antara reaktan dan produk tidak berbeda, ada empat atom hidrogen dan dua atom oksigen di setiap sisi reaksi.
Lihat juga:
- Subjek
- Perubahan keadaan masalah
Penemuan hukum kekekalan materi
Penemuan hukum ini terjadi pada abad ke-18 karena adanya kekhawatiran di komunitas ilmiah tentang hilangnya materi dalam proses tertentu seperti pembakaran.
Pada 1748 Mikhail Lomonosov, seorang sarjana terkemuka dalam berbagai seni dan sains, membuat formulasi pertama dari undang-undang ini.
“Dalam reaksi kimia, materi dilestarikan, massa awal sama dengan massa yang dihasilkan” (M. Lomonosov, 1748)
Bertahun-tahun kemudian, pada 1785, Antoine Lavoisier, seorang pengacara, ekonom, dan ilmuwan Prancis, merumuskan kembali undang-undang tersebut, menambahkan nuansa baru.
“Unsur-unsur yang berpartisipasi dalam reaksi kimia masing-masing mempertahankan massanya sendiri setelah reaksi” (A. Lavoisier, 1785)
Untuk alasan ini hukum kekekalan materi juga dikenal sebagai hukum Lomonosov-Lavoisier.
Kedua ilmuwan tersebut menggunakan, untuk pertama kalinya, metode untuk mengukur dan menimbang secara akurat, yang merupakan kemajuan penting dalam kimia dan berkontribusi pada penemuan hukum fundamentalnya.
Aplikasi Hukum Kekekalan Materi
Industri Kimia
Hukum Kekekalan Materi digunakan dalam industri kimia untuk merancang dan mengoptimalkan reaksi kimia. Dengan memahami bahwa massa harus tetap konstan, insinyur dapat menghitung jumlah bahan yang diperlukan dan memperkirakan hasil produk.
Biologi dan Ekologi
Dalam biologi, prinsip kekekalan materi diterapkan dalam siklus biogeokimia seperti siklus karbon dan nitrogen. Di ekosistem, materi berpindah dari satu bentuk ke bentuk lain, tetapi jumlah totalnya tetap konstan. Ini membantu ilmuwan memahami bagaimana nutrisi bergerak melalui lingkungan.
Teknik dan Rekayasa
Dalam bidang teknik, hukum kekekalan materi digunakan dalam perhitungan dan desain sistem, seperti pengolahan limbah dan produksi energi. Prinsip ini membantu insinyur memastikan efisiensi dan keberlanjutan proses.
Pendidikan
Hukum Kekekalan Materi adalah konsep dasar yang diajarkan di sekolah-sekolah untuk membantu siswa memahami prinsip-prinsip kimia dasar. Melalui eksperimen dan latihan, siswa belajar bagaimana menghitung massa reaktan dan produk dalam reaksi kimia.
Tantangan dan Inovasi
Perkembangan dalam Fisika Kuantum
Dalam skala kuantum, konsep kekekalan materi menjadi lebih kompleks. Partikel subatomik dapat berubah bentuk dan bahkan “menghilang” dan “muncul kembali” di tempat lain, menantang pemahaman klasik tentang kekekalan materi. Penelitian dalam fisika kuantum terus berkembang untuk menjelaskan fenomena ini.
Konservasi Energi dan Materi
Hukum Kekekalan Materi sering dikaitkan dengan hukum kekekalan energi, terutama dalam konteks teori relativitas Einstein yang menyatakan bahwa massa dan energi adalah setara (E=mc2). Ini menunjukkan bahwa dalam reaksi nuklir, massa dapat diubah menjadi energi.
Kesimpulan
Hukum Kekekalan Materi adalah prinsip fundamental yang membentuk dasar pemahaman kita tentang reaksi kimia dan proses fisika. Dengan menyatakan bahwa materi tidak dapat diciptakan atau dimusnahkan, hukum ini memungkinkan ilmuwan dan insinyur untuk merancang dan mengoptimalkan proses yang berkelanjutan dan efisien. Meskipun tantangan muncul dalam skala kuantum, prinsip kekekalan materi tetap menjadi pilar penting dalam ilmu pengetahuan.
Referensi
- Lavoisier, A. L. (1789). Traité Élémentaire de Chimie. Paris: Chez Cuchet.
- Brown, T. L., LeMay, H. E., & Bursten, B. E. (2012). Chemistry: The Central Science. Pearson Education.
- Atkins, P., & de Paula, J. (2014). Physical Chemistry. Oxford University Press.
- Raven, P. H., & Johnson, G. B. (2013). Biology. McGraw-Hill Education.
- Callister, W. D., & Rethwisch, D. G. (2018). Materials Science and Engineering: An Introduction. Wiley.