Massa molar adalah salah satu konsep fundamental dalam kimia yang sangat penting untuk menghitung jumlah zat di dalam suatu reaksi kimia. Massa molar memungkinkan kita menghitung berapa banyak atom, molekul, atau ion yang terlibat dalam suatu reaksi berdasarkan massa zat tersebut. Dalam artikel ini, kita akan membahas secara detail apa itu massa molar, bagaimana cara menghitungnya, dan bagaimana konsep ini diterapkan dalam berbagai contoh.
Pengertian Massa Molar
Massa molar didefinisikan sebagai massa satu mol dari suatu zat (atom, molekul, atau senyawa), dan biasanya dinyatakan dalam satuan gram per mol (g/mol).
Konsep mol sangat penting dalam kimia karena satu mol zat mengandung sejumlah partikel (atom, molekul, atau ion) yang sama dengan bilangan Avogadro, yaitu sekitar 6,022 × 10²³ partikel. Dengan kata lain, satu mol zat apapun (baik itu unsur atau senyawa) mengandung jumlah partikel yang sama, sehingga massa molar menghubungkan massa makroskopis suatu zat dengan jumlah partikel mikroskopis yang dikandungnya.
Rumus Massa Molar:

Atau, jika kita mengetahui jumlah mol dan massa molar suatu zat:
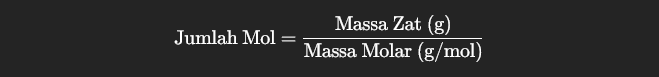
Hubungan antara Massa Atom dan Massa Molar
Massa molar suatu unsur berkaitan erat dengan massa atom relatif unsur tersebut, yang biasanya dinyatakan dalam satuan atomic mass unit (u). Massa atom relatif dapat ditemukan pada tabel periodik unsur dan menyatakan massa satu atom unsur tersebut relatif terhadap massa satu atom karbon-12.
Untuk menghitung massa molar unsur, kita dapat menggunakan massa atom relatif dari unsur tersebut, tetapi dalam satuan gram per mol. Dengan kata lain, massa molar suatu unsur dalam g/mol adalah angka yang sama dengan massa atom relatifnya, tetapi dengan satuan yang berbeda.
Contoh:
- Hidrogen (H) memiliki massa atom relatif sekitar 1 u, sehingga massa molar hidrogen adalah 1 g/mol.
- Karbon (C) memiliki massa atom relatif sekitar 12 u, sehingga massa molar karbon adalah 12 g/mol.
- Oksigen (O) memiliki massa atom relatif sekitar 16 u, sehingga massa molar oksigen adalah 16 g/mol.
Massa Molar Senyawa
Untuk senyawa kimia, massa molar dihitung dengan menjumlahkan massa molar dari setiap unsur penyusunnya berdasarkan rumus kimia senyawa tersebut. Berikut adalah langkah-langkah dalam menghitung massa molar senyawa:
- Tentukan rumus kimia senyawa tersebut.
- Cari massa atom relatif dari setiap unsur dalam senyawa tersebut menggunakan tabel periodik.
- Kalikan massa atom relatif dengan jumlah atom dari unsur tersebut dalam rumus kimia.
- Jumlahkan hasil kali untuk semua unsur dalam senyawa untuk mendapatkan massa molar senyawa.
Contoh Perhitungan Massa Molar Senyawa:
1. Massa Molar Air (H₂O)
Rumus kimia air adalah H₂O, yang berarti terdapat dua atom hidrogen (H) dan satu atom oksigen (O) dalam setiap molekul air.
- Massa atom relatif hidrogen (H) = 1 u
- Massa atom relatif oksigen (O) = 16 u
Maka, untuk menghitung massa molar air:
Massa Molar H₂O=(2×1g/mol)+(1×16g/mol)=2g/mol+16g/mol=18g/mol
Dengan demikian, massa molar air adalah 18 g/mol. Artinya, satu mol air memiliki massa 18 gram.
2. Massa Molar Karbon Dioksida (CO₂)
Rumus kimia karbon dioksida adalah CO₂, yang berarti terdapat satu atom karbon (C) dan dua atom oksigen (O) dalam setiap molekul karbon dioksida.
- Massa atom relatif karbon (C) = 12 u
- Massa atom relatif oksigen (O) = 16 u
Maka, untuk menghitung massa molar karbon dioksida:
Massa Molar CO₂=(1×12g/mol)+(2×16g/mol)=12g/mol+32g/mol=44g/mol
Dengan demikian, massa molar karbon dioksida adalah 44 g/mol. Artinya, satu mol karbon dioksida memiliki massa 44 gram.
Dengan demikian, massa molar karbon dioksida adalah 44 g/mol. Artinya, satu mol karbon dioksida memiliki massa 44 gram.
3. Massa Molar Glukosa (C₆H₁₂O₆)
Rumus kimia glukosa adalah C₆H₁₂O₆, yang berarti terdapat 6 atom karbon (C), 12 atom hidrogen (H), dan 6 atom oksigen (O) dalam setiap molekul glukosa.
- Massa atom relatif karbon (C) = 12 u
- Massa atom relatif hidrogen (H) = 1 u
- Massa atom relatif oksigen (O) = 16 u
Maka, untuk menghitung massa molar glukosa:
Massa Molar C₆H₁₂O₆=(6×12g/mol)+(12×1g/mol)+(6×16g/mol)
Massa Molar C₆H₁₂O₆=(6×12g/mol)+(12×1g/mol)+(6×16g/mol)
=72 g/mol+12 g/mol+96 g/mol=180 g/mol= 72
Dengan demikian, massa molar glukosa adalah 180 g/mol.
Menghitung Jumlah Mol dari Massa Zat
Salah satu penggunaan utama massa molar adalah menghitung jumlah mol dari suatu zat berdasarkan massanya. Rumus yang digunakan adalah:
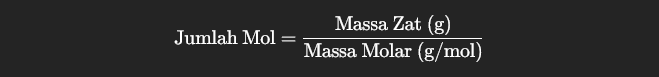
Contoh Soal 1:
Berapa mol molekul air (H₂O) yang terdapat dalam 36 gram air?
Diketahui:
- Massa molar air (H₂O) = 18 g/mol
- Massa air = 36 gram
Jumlah Mol=18g/36g/mol=2mol
Jadi, terdapat 2 mol air dalam 36 gram air.
Contoh Soal 2:
Jika Anda memiliki 88 gram karbon dioksida (CO₂), berapa mol karbon dioksida yang Anda miliki?
Diketahui:
- Massa molar CO₂ = 44 g/mol
- Massa karbon dioksida = 88 gram
Jumlah Mol=44g/88g/mol=2mol
Jadi, terdapat 2 mol karbon dioksida dalam 88 gram karbon dioksida.
Menghitung Massa dari Jumlah Mol
Sebaliknya, kita juga bisa menghitung massa suatu zat jika kita mengetahui jumlah molnya. Rumus yang digunakan adalah:
Massa Zat (g)=Jumlah Mol×Massa Molar (g/mol)
Contoh Soal 3:
Berapa gram glukosa (C₆H₁₂O₆) yang terdapat dalam 0,5 mol glukosa?
Diketahui:
- Massa molar glukosa = 180 g/mol
- Jumlah mol = 0,5 mol
Massa Glukosa (g)=0,5 mol×180 g/mol=90 g
Jadi, terdapat 90 gram glukosa dalam 0,5 mol glukosa.
Contoh Aplikasi dalam Kehidupan Sehari-Hari
- Industri Farmasi
Dalam industri farmasi, massa molar digunakan untuk menghitung dosis obat yang tepat. Sebagai contoh, pengobatan dengan aspirin (asam asetilsalisilat, C₉H₈O₄) memerlukan perhitungan jumlah mol zat aktif berdasarkan massa molar agar dosis yang diberikan tepat dan tidak berlebihan.
- Reaksi Kimia di Laboratorium
Dalam laboratorium kimia, ilmuwan sering kali menghitung massa molar untuk menentukan jumlah reaktan yang diperlukan dalam suatu reaksi kimia. Misalnya, dalam reaksi pembakaran metana (CH₄), massa molar metana dan oksigen dihitung untuk memastikan jumlah reaktan yang tepat.
- Bidang Lingkungan
Dalam analisis lingkungan, massa molar digunakan untuk mengukur konsentrasi gas-gas rumah kaca seperti karbon dioksida (CO₂) di atmosfer. Ini membantu para ilmuwan dalam mempelajari dampak perubahan iklim dan mengukur jumlah emisi gas.
Kesimpulan
Massa molar adalah konsep penting dalam kimia yang menghubungkan massa suatu zat dengan jumlah partikel (mol) yang dikandungnya. Dengan menggunakan massa molar, kita dapat menghitung jumlah mol, massa zat, dan memprediksi bagaimana zat-zat tersebut bereaksi dalam suatu proses kimia. Massa molar juga sangat penting dalam aplikasi praktis di berbagai bidang seperti farmasi, industri, lingkungan, dan penelitian ilmiah.
Melalui pemahaman mendalam tentang massa molar, kita dapat lebih tepat dalam mengukur dan memprediksi hasil dari reaksi kimia, baik dalam skala laboratorium maupun industri.