Larutan hipertonik adalah larutan yang memiliki konsentrasi zat terlarut lebih tinggi dibandingkan dengan larutan lain yang dibandingkan dengannya, biasanya larutan di dalam sel. Dalam konteks biologi, larutan hipertonik sering digunakan untuk menggambarkan kondisi di mana konsentrasi zat terlarut di luar sel lebih tinggi daripada di dalam sel. Akibatnya, air akan bergerak keluar dari sel melalui proses osmosis, yang dapat menyebabkan sel mengecil atau mengerut.
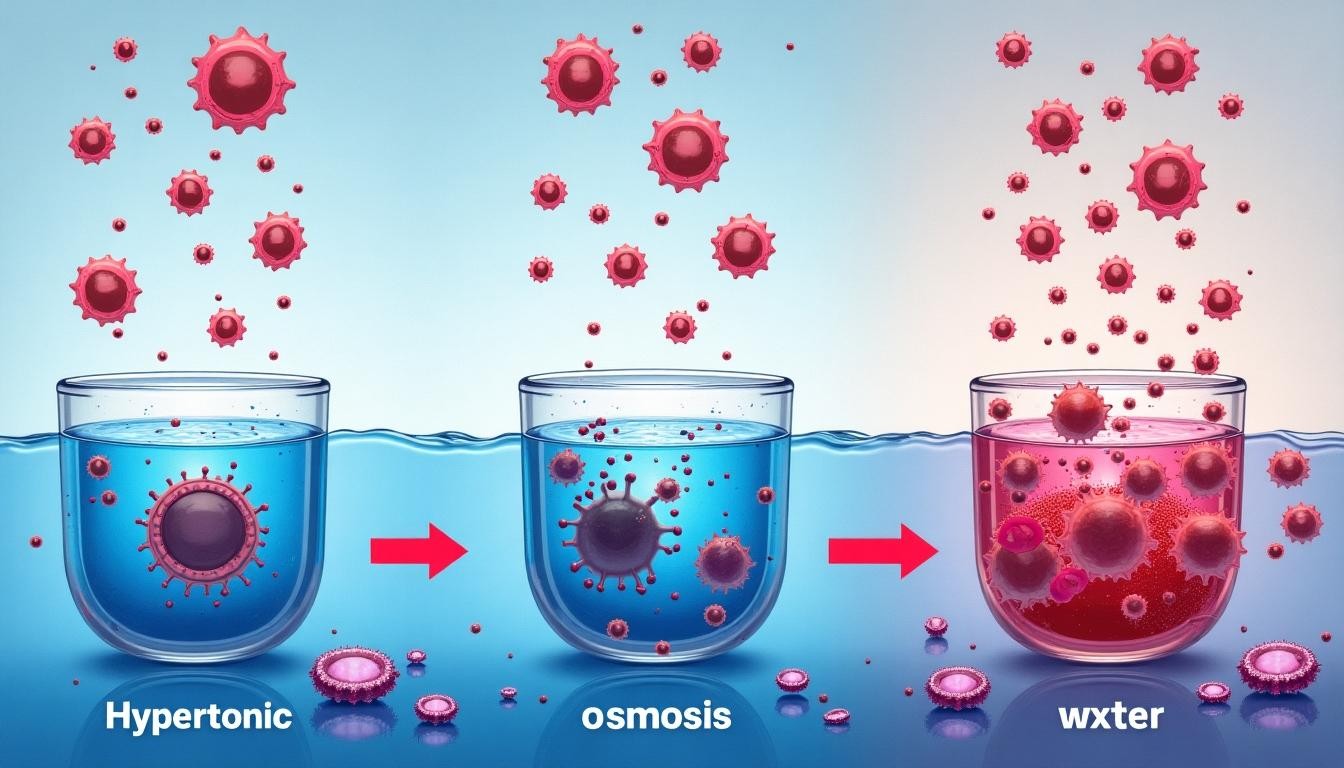
Fenomena ini sangat penting dalam berbagai proses biologis dan medis, serta dalam kehidupan sehari-hari. Memahami larutan hipertonik membantu kita mengerti bagaimana sel berinteraksi dengan lingkungan sekitarnya dan bagaimana keseimbangan cairan dipertahankan di dalam tubuh.
Pengertian Larutan Hipertonik
Secara sederhana, larutan hipertonik adalah larutan yang memiliki konsentrasi zat terlarut (misalnya, garam, gula, atau ion-ion lain) lebih tinggi daripada larutan yang dibandingkan dengannya. Jika kita membandingkan dua larutan yang dipisahkan oleh membran semipermeabel (seperti membran sel), larutan yang memiliki konsentrasi zat terlarut lebih besar disebut hipertonik.
Dalam konteks osmosis, air selalu bergerak dari larutan dengan konsentrasi zat terlarut yang lebih rendah (hipotonik) ke larutan dengan konsentrasi zat terlarut yang lebih tinggi (hipertonik). Ini terjadi karena air ingin mencapai keseimbangan konsentrasi di kedua sisi membran. Pada larutan hipertonik, karena jumlah zat terlarut lebih tinggi di luar sel, air cenderung bergerak keluar dari sel menuju larutan hipertonik, menyebabkan sel kehilangan air dan menyusut.
Mekanisme Osmosis dalam Larutan Hipertonik
Osmosis adalah proses perpindahan air dari area dengan konsentrasi air yang lebih tinggi (larutan hipotonik) ke area dengan konsentrasi air yang lebih rendah (larutan hipertonik) melalui membran semipermeabel. Membran semipermeabel hanya memungkinkan air melewati, tetapi tidak zat terlarut.
Ketika sel berada dalam larutan hipertonik, air di dalam sel (yang berada dalam konsentrasi lebih rendah) akan bergerak keluar menuju larutan hipertonik di luar sel. Hal ini menyebabkan dehidrasi seluler yang dikenal sebagai plasmolisis pada sel tumbuhan dan krenasi pada sel hewan.
Proses Osmosis dalam Larutan Hipertonik:
- Konsentrasi Zat Terlarut Lebih Tinggi di Luar Sel:
Larutan hipertonik memiliki konsentrasi zat terlarut yang lebih tinggi dibandingkan dengan cairan di dalam sel. Sebagai contoh, larutan garam hipertonik mengandung lebih banyak ion natrium dan klorida daripada cairan di dalam sel. - Gerakan Air Keluar dari Sel:
Karena air bergerak dari area dengan konsentrasi air yang lebih tinggi ke area dengan konsentrasi air yang lebih rendah, air akan keluar dari sel yang berada dalam larutan hipertonik. Membran sel bertindak sebagai membran semipermeabel, yang memungkinkan air bergerak melaluinya, tetapi tidak molekul besar atau ion. - Pengkerutan Sel:
Ketika air keluar dari sel, sel mulai kekurangan air dan mengecil atau mengerut. Pada sel tumbuhan, membran plasma terpisah dari dinding sel, menyebabkan fenomena yang disebut plasmolisis. Pada sel hewan, sel akan mengerut dalam proses yang disebut krenasi. - Keseimbangan Osmotik:
Proses ini berlangsung sampai konsentrasi air dan zat terlarut di dalam dan di luar sel mencapai keseimbangan, atau sampai kondisi eksternal berubah.
Contoh Sederhana Mekanisme Osmosis
Misalkan kita memiliki sel darah merah yang ditempatkan dalam larutan garam hipertonik (misalnya, larutan garam dengan konsentrasi 10%). Karena konsentrasi garam di luar sel lebih tinggi daripada di dalam sel, air akan bergerak keluar dari sel darah merah menuju larutan garam. Akibatnya, sel darah merah akan kehilangan air, mengecil, dan menjadi keriput (krenasi).
Perbedaan Larutan Hipertonik, Hipotonik, dan Isotonik
Untuk memahami konsep larutan hipertonik dengan lebih baik, penting untuk mengetahui perbedaan antara larutan hipotonik, isotonik, dan hipertonik:
- Larutan Hipotonik: Larutan yang memiliki konsentrasi zat terlarut lebih rendah daripada larutan lain yang dibandingkan dengannya. Dalam larutan hipotonik, air bergerak masuk ke dalam sel, menyebabkan sel membengkak atau bahkan pecah (lisis).
- Larutan Isotonik: Larutan yang memiliki konsentrasi zat terlarut yang sama dengan larutan lain yang dibandingkan dengannya. Dalam larutan isotonik, tidak ada pergerakan air bersih ke dalam atau ke luar sel karena konsentrasi zat terlarut di dalam dan di luar sel sama. Sel tetap dalam ukuran normal.
- Larutan Hipertonik: Larutan yang memiliki konsentrasi zat terlarut lebih tinggi daripada larutan lain yang dibandingkan dengannya. Dalam larutan hipertonik, air bergerak keluar dari sel, menyebabkan sel mengalami dehidrasi dan mengecil.
Contoh Sederhana Larutan Hipertonik dalam Kehidupan Sehari-Hari
Untuk memberikan pemahaman yang lebih jelas mengenai larutan hipertonik, berikut adalah beberapa contoh sederhana dari kehidupan sehari-hari:
1. Penggunaan Larutan Garam untuk Mengawetkan Makanan
Salah satu aplikasi larutan hipertonik yang umum adalah dalam pengawetan makanan, seperti penggaraman ikan atau daging. Ketika ikan atau daging direndam dalam larutan garam pekat (hipertonik), air dalam sel-sel organisme tersebut akan keluar. Ini mengurangi kadar air di dalam makanan, yang menghambat pertumbuhan bakteri dan mikroorganisme yang memerlukan air untuk bertahan hidup.
Penjelasan sederhana: Garam bertindak sebagai larutan hipertonik yang menyebabkan air keluar dari sel-sel makanan, sehingga makanan menjadi lebih awet karena bakteri tidak dapat berkembang biak di lingkungan yang kering.
2. Keringat dan Dehidrasi
Ketika seseorang berkeringat banyak, tubuh kehilangan air, dan darah menjadi lebih pekat dengan zat terlarut seperti garam dan elektrolit. Akibatnya, cairan dalam sel-sel tubuh mungkin mengalir keluar ke pembuluh darah untuk menyeimbangkan konsentrasi zat terlarut. Ini dapat menyebabkan dehidrasi, yang mirip dengan efek yang dihasilkan oleh larutan hipertonik.
Penjelasan sederhana: Ketika seseorang dehidrasi, cairan dalam tubuh menjadi lebih pekat (hipertonik). Ini menyebabkan air keluar dari sel-sel tubuh, yang dapat menyebabkan sel-sel kehilangan air dan berfungsi kurang optimal.
3. Penggunaan Larutan Garam Hipertonik dalam Perawatan Medis
Dalam situasi medis tertentu, larutan garam hipertonik digunakan untuk mengurangi pembengkakan atau edema. Misalnya, larutan garam hipertonik dapat diberikan secara intravena untuk menarik cairan berlebih dari jaringan tubuh yang bengkak ke dalam pembuluh darah, di mana cairan tersebut dapat dikeluarkan dari tubuh.
Penjelasan sederhana: Larutan garam hipertonik digunakan dalam perawatan medis untuk mengurangi pembengkakan dengan menarik air keluar dari jaringan tubuh yang mengalami edema.
4. Larutan Hipertonik pada Sel Tumbuhan
Ketika sel tumbuhan terkena larutan hipertonik, air cenderung keluar dari sel, menyebabkan kondisi yang disebut plasmolisis. Plasmolisis menyebabkan sel menyusut dan tanaman layu. Namun, beberapa tumbuhan telah beradaptasi dengan lingkungan hipertonik dengan mengembangkan mekanisme untuk menahan air dan mempertahankan tekanan turgor, sehingga memungkinkan mereka bertahan hidup dalam kondisi kering.
Signifikansi Hipertonisitas
Memahami hipertonisitas sangat penting dalam berbagai bidang, termasuk biologi, kedokteran, dan ilmu pangan. Efek larutan hipertonik pada sel dan organisme mempunyai implikasi terhadap kesehatan manusia, kelangsungan hidup organisme laut, pengawetan makanan, dan adaptasi tanaman terhadap lingkungan yang berbeda. Dengan mempelajari dan memanipulasi hipertonisitas, ilmuwan dan peneliti dapat memperoleh wawasan tentang proses seluler, mengembangkan perawatan medis, dan meningkatkan teknik pengawetan makanan.
Kesimpulan: Larutan Hipertonik dan Dampaknya terhadap Sel dan Organisme
Larutan hipertonik memainkan peran penting dalam biologi, kedokteran, dan ilmu pangan. Contoh-contoh yang dibahas dalam artikel ini, seperti organisme air asin dan laut, larutan hipertonik dalam aplikasi medis, dehidrasi, larutan hipertonik dalam pengawetan makanan, dan hipertonisitas dalam sel tumbuhan, menyoroti beragam manifestasi hipertonisitas dan pengaruhnya terhadap sel dan organisme. Memahami perilaku larutan hipertonik sangat penting untuk menjaga fungsi sel, mengobati kondisi medis, mengawetkan makanan, dan mempelajari adaptasi organisme terhadap lingkungan yang berbeda. Dengan mengungkap misteri hipertonisitas, para ilmuwan terus memperluas pengetahuan kita tentang keseimbangan rumit antara zat terlarut dan air dalam sistem biologis.