Aldehid dan keton adalah dua kelompok senyawa organik yang memiliki gugus karbonil (![]() ) sebagai ciri khas. Senyawa-senyawa ini penting dalam kimia organik dan memiliki peran yang sangat luas dalam berbagai proses kimia dan biokimia. Meskipun aldehid dan keton sama-sama memiliki gugus karbonil, keduanya berbeda dalam hal struktur, sifat kimia, reaktivitas, dan penggunaannya.
) sebagai ciri khas. Senyawa-senyawa ini penting dalam kimia organik dan memiliki peran yang sangat luas dalam berbagai proses kimia dan biokimia. Meskipun aldehid dan keton sama-sama memiliki gugus karbonil, keduanya berbeda dalam hal struktur, sifat kimia, reaktivitas, dan penggunaannya.

Artikel ini akan membahas secara mendalam perbedaan antara aldehid dan keton, mulai dari struktur molekul hingga perbedaan reaktivitasnya, serta beberapa contoh senyawa aldehid dan keton yang sering ditemui dalam kehidupan sehari-hari.
Apa Itu Aldehid?
Aldehid adalah senyawa organik yang memiliki gugus karbonil (![]() ) yang terikat pada atom karbon yang berada di ujung rantai karbon. Dalam struktur aldehid, gugus karbonil selalu berada di posisi terminal (ujung) dari rantai karbon dan terikat pada satu atom hidrogen dan satu gugus alkil atau aril. Gugus karbonil pada aldehid ditulis dengan rumus umum
) yang terikat pada atom karbon yang berada di ujung rantai karbon. Dalam struktur aldehid, gugus karbonil selalu berada di posisi terminal (ujung) dari rantai karbon dan terikat pada satu atom hidrogen dan satu gugus alkil atau aril. Gugus karbonil pada aldehid ditulis dengan rumus umum ![]() , di mana
, di mana ![]() adalah gugus alkil atau aril yang terikat pada gugus karbonil.
adalah gugus alkil atau aril yang terikat pada gugus karbonil.
Contoh aldehid yang terkenal adalah formaldehid (metanal) dan asetaldehid (etanal):
- Formaldehid: Formaldehid adalah aldehid yang paling sederhana, dengan rumus molekul
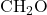 . Formaldehid banyak digunakan sebagai pengawet dalam preparasi biologis dan disinfektan.
. Formaldehid banyak digunakan sebagai pengawet dalam preparasi biologis dan disinfektan. - Asetaldehid: Asetaldehid adalah aldehid dengan dua atom karbon, yang memiliki rumus molekul
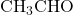 . Asetaldehid ditemukan secara alami dalam buah-buahan dan merupakan hasil oksidasi etanol.
. Asetaldehid ditemukan secara alami dalam buah-buahan dan merupakan hasil oksidasi etanol.
Apa Itu Keton?
Keton adalah senyawa organik yang memiliki gugus karbonil (![]() ) yang terikat pada dua atom karbon di dalam rantai karbon. Berbeda dengan aldehid, gugus karbonil pada keton tidak berada di ujung rantai karbon, melainkan di posisi tengah atau antara dua atom karbon lainnya. Rumus umum untuk keton adalah
) yang terikat pada dua atom karbon di dalam rantai karbon. Berbeda dengan aldehid, gugus karbonil pada keton tidak berada di ujung rantai karbon, melainkan di posisi tengah atau antara dua atom karbon lainnya. Rumus umum untuk keton adalah ![]() , di mana
, di mana ![]() dan
dan ![]() adalah gugus alkil atau aril yang berbeda atau sama, tergantung pada jenis ketonnya.
adalah gugus alkil atau aril yang berbeda atau sama, tergantung pada jenis ketonnya.
Contoh keton yang umum adalah aseton (propanon) dan metil etil keton (butanon):
- Aseton: Aseton adalah keton yang paling sederhana, dengan rumus molekul
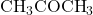 . Aseton banyak digunakan sebagai pelarut organik dalam berbagai industri dan juga sebagai bahan pembersih.
. Aseton banyak digunakan sebagai pelarut organik dalam berbagai industri dan juga sebagai bahan pembersih. - Metil etil keton: Metil etil keton memiliki rumus molekul
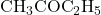 . Keton ini sering digunakan sebagai pelarut dalam industri cat dan pelapis.
. Keton ini sering digunakan sebagai pelarut dalam industri cat dan pelapis.
Perbedaan Struktur antara Aldehid dan Keton
Perbedaan utama antara aldehid dan keton terletak pada posisi gugus karbonil dalam struktur molekulnya.
1. Posisi Gugus Karbonil:
- Aldehid: Gugus karbonil (
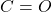 ) pada aldehid selalu berada di ujung rantai karbon, terikat pada satu atom hidrogen dan satu gugus alkil atau aril. Karena gugus karbonil berada di ujung rantai, aldehid lebih reaktif dan lebih mudah teroksidasi.
) pada aldehid selalu berada di ujung rantai karbon, terikat pada satu atom hidrogen dan satu gugus alkil atau aril. Karena gugus karbonil berada di ujung rantai, aldehid lebih reaktif dan lebih mudah teroksidasi. - Keton: Gugus karbonil pada keton berada di posisi tengah, terikat pada dua gugus alkil atau aril di kedua sisinya. Gugus karbonil yang terletak di tengah rantai karbon membuat keton lebih stabil dan kurang reaktif dibandingkan aldehid.
Contoh:
- Aldehid: Etanal (
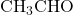 ) memiliki gugus karbonil di ujung, terikat pada atom hidrogen dan gugus metil (
) memiliki gugus karbonil di ujung, terikat pada atom hidrogen dan gugus metil ( ).
). - Keton: Aseton (
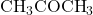 ) memiliki gugus karbonil yang terletak di tengah antara dua gugus metil (
) memiliki gugus karbonil yang terletak di tengah antara dua gugus metil (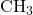 ).
).
2. Rumus Molekul:
- Aldehid: Ditulis sebagai
 .
. - Keton: Ditulis sebagai
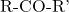 .
.
Sifat Fisik Aldehid dan Keton
Aldehid dan keton memiliki beberapa perbedaan dalam hal sifat fisik, terutama yang terkait dengan titik didih, kelarutan, dan bau.
1. Titik Didih:
- Aldehid: Titik didih aldehid biasanya lebih rendah dibandingkan keton dengan jumlah atom karbon yang sama. Hal ini disebabkan oleh interaksi molekul yang lebih lemah pada aldehid.
- Keton: Titik didih keton umumnya lebih tinggi karena adanya interaksi antar molekul yang lebih kuat akibat posisi gugus karbonil di tengah molekul.
Contoh: Titik didih formaldehid (sebagai larutan formalin) lebih rendah dibandingkan aseton. Aseton yang merupakan keton lebih stabil dan memiliki titik didih yang lebih tinggi.
2. Kelarutan dalam Air:
- Aldehid dan Keton dengan rantai karbon pendek keduanya larut dalam air. Gugus karbonil yang polar membuat senyawa aldehid dan keton dapat berinteraksi dengan molekul air melalui ikatan hidrogen. Namun, semakin panjang rantai karbonnya, kelarutan aldehid dan keton dalam air akan berkurang.
Contoh: Formaldehid dan aseton larut dalam air, tetapi heksanal (aldehid dengan enam atom karbon) dan heksanon (keton dengan enam atom karbon) memiliki kelarutan yang lebih rendah dalam air karena rantai karbon yang lebih panjang dan sifat yang lebih nonpolar.
3. Bau:
- Aldehid: Aldehid biasanya memiliki bau yang kuat, menyengat, dan khas. Bau ini sering kali tidak menyenangkan dan dapat menyebabkan iritasi.
- Keton: Keton biasanya memiliki bau yang lebih lembut dan manis dibandingkan aldehid.
Contoh: Formaldehid memiliki bau menyengat yang sangat khas dan sering kali tidak disukai, sementara aseton memiliki bau yang lebih ringan dan manis.
Perbedaan Sifat Kimia dan Reaktivitas Aldehid dan Keton
Aldehid dan keton memiliki perbedaan reaktivitas yang signifikan karena perbedaan struktur molekulnya. Gugus karbonil pada aldehid yang berada di ujung rantai karbon membuatnya lebih reaktif, terutama dalam reaksi oksidasi, dibandingkan dengan keton.
1. Reaksi Oksidasi:
- Aldehid: Aldehid mudah teroksidasi menjadi asam karboksilat karena adanya atom hidrogen yang terikat pada gugus karbonil. Oksidasi aldehid dapat dilakukan dengan agen pengoksidasi, seperti larutan kalium permanganat (
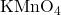 ) atau kalium dikromat (
) atau kalium dikromat (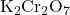 ).
). - Keton: Keton lebih tahan terhadap oksidasi dibandingkan aldehid. Untuk mengoksidasi keton menjadi senyawa lain, diperlukan kondisi yang lebih keras, sehingga keton lebih stabil dalam kondisi oksidatif.
Contoh: Asetaldehid (![]() ) dapat dioksidasi menjadi asam asetat (
) dapat dioksidasi menjadi asam asetat (![]() ) dengan mudah, sedangkan aseton (
) dengan mudah, sedangkan aseton (![]() ) relatif lebih stabil dan tidak teroksidasi di bawah kondisi biasa.
) relatif lebih stabil dan tidak teroksidasi di bawah kondisi biasa.
2. Uji Reaksi Aldehid dan Keton:
- Aldehid dan keton dapat dibedakan dengan menggunakan uji Fehling dan uji Tollens. Aldehid akan bereaksi positif terhadap kedua uji ini, sedangkan keton tidak memberikan hasil positif.
Uji Fehling: Aldehid bereaksi dengan larutan Fehling, menghasilkan endapan merah bata sebagai tanda adanya aldehid. Keton tidak bereaksi dengan larutan Fehling.
Uji Tollens: Aldehid bereaksi dengan larutan Tollens membentuk endapan perak (cermin perak) pada dinding tabung reaksi, sedangkan keton tidak memberikan reaksi positif pada uji ini.
Contoh: Jika kita menguji formaldehid dengan larutan Tollens, kita akan melihat terbentuknya cermin perak pada tabung reaksi, yang menunjukkan adanya gugus aldehid. Sebaliknya, jika kita menguji aseton dengan larutan Tollens, tidak akan ada perubahan yang terjadi.
3. Reaksi Reduksi:
- Aldehid dan Keton keduanya dapat mengalami reaksi reduksi. Aldehid dapat direduksi menjadi alkohol primer, sementara keton dapat direduksi menjadi alkohol sekunder.
Contoh: Asetaldehid dapat direduksi menjadi etanol, sementara aseton dapat direduksi menjadi isopropanol.
Contoh Penggunaan Aldehid dan Keton dalam Kehidupan Sehari-hari
Aldehid dan keton memiliki aplikasi yang luas dalam berbagai industri, mulai dari farmasi hingga kosmetik dan bahan kimia industri. Berikut beberapa contoh senyawa aldehid dan keton yang memiliki kegunaan dalam kehidupan sehari-hari.
Penggunaan Aldehid
1. Formaldehid: Formaldehid digunakan sebagai pengawet dalam industri kimia dan biologi, serta dalam pembuatan resin formaldehid yang digunakan dalam produksi kayu lapis dan papan partikel.
- Contoh: Formaldehid sering digunakan dalam larutan formalin untuk pengawetan spesimen biologi.
2. Asetaldehid: Asetaldehid banyak digunakan dalam industri kimia sebagai bahan dasar untuk memproduksi berbagai senyawa kimia lainnya, termasuk asam asetat.
- Contoh: Asetaldehid merupakan produk sampingan dari fermentasi alkohol dan sering digunakan dalam pembuatan parfum.
Penggunaan Keton
1. Aseton: Aseton adalah pelarut organik yang sangat umum dan banyak digunakan dalam produk pembersih, penghapus cat kuku, dan industri farmasi.
- Contoh: Penghapus cat kuku mengandung aseton sebagai bahan utama karena kemampuannya melarutkan cat dengan mudah.
2. Metil Etil Keton (MEK): MEK adalah pelarut yang kuat dan sering digunakan dalam industri cat, pelapis, dan perekat.
- Contoh: MEK digunakan dalam industri otomotif sebagai pelarut untuk membersihkan dan melarutkan berbagai jenis cat dan pelapis.
Kesimpulan
Aldehid dan keton adalah dua kelompok senyawa organik yang memiliki gugus karbonil sebagai ciri khas, namun berbeda dalam struktur dan sifat kimianya. Aldehid memiliki gugus karbonil di ujung rantai karbon, membuatnya lebih reaktif dan mudah teroksidasi, serta memberikan hasil positif pada uji Fehling dan Tollens. Keton, di sisi lain, memiliki gugus karbonil di antara dua atom karbon, membuatnya lebih stabil dan tahan terhadap oksidasi.
Perbedaan ini membuat aldehid dan keton memiliki aplikasi yang berbeda dalam industri. Formaldehid dan asetaldehid banyak digunakan dalam industri kimia dan farmasi, sedangkan keton seperti aseton dan MEK digunakan sebagai pelarut. Dengan memahami perbedaan ini, kita dapat lebih memahami peran aldehid dan keton dalam kimia dan aplikasinya dalam kehidupan sehari-hari.